سرعة التفاعل الكيميائي علوم 3 اعدادي الترم الثاني
التفاعل الكيميائي : عملية تتضمن تحول مواد كيميائية(المتفاعلات ) الي مواد كيميائية اخري(النواتج).
ولكن تختلف في سرعة حدوثها :
تفاعلات سريعة جدًا تتم في وقت قصيرجدًا مثل تفاعل الألعاب النارية.
تفاعلات بطيئة نسبيًا تتم في وقت قصير مثل تفاعل الزيت مع الصودا الكاوية لتكوين الصابون.
تفاعلات بطيئة جدًا تحتاج لعدة شهور مثل تفاعل صدأ الحديد.
تفاعلات بطيئة جدًا جدًأ تحتاج لملايين السنين مثل تفاعل تكوين النفط في باطن الأرض.
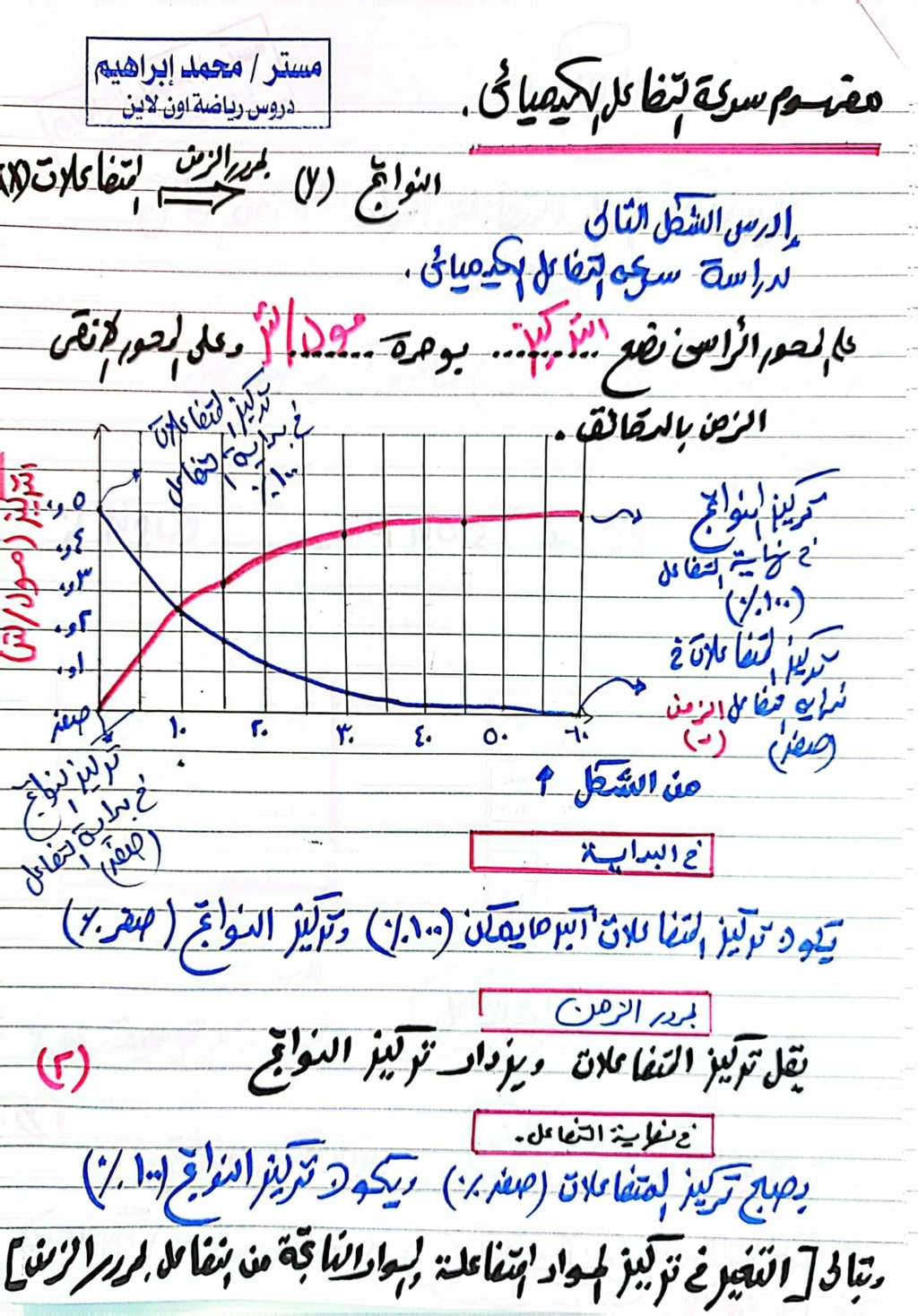
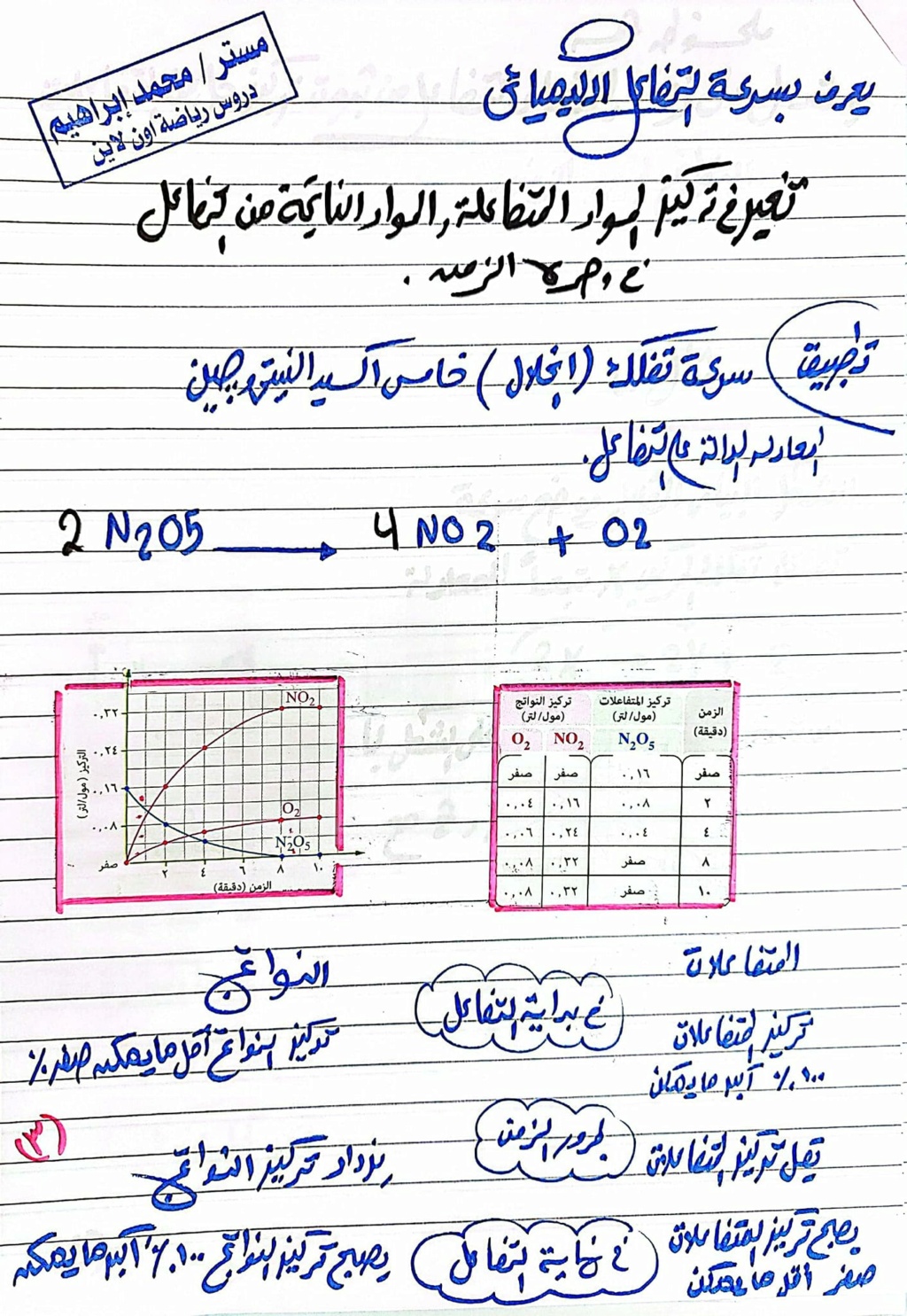
سرعة التفاعل الكيميائي : التغير في تركيز المواد المتفاعلة والمواد الناتجة من التفاعل في وحدة الزمن.
حيث أنه في بداية التفاعل :تكون نسبة المتفاعلات أكبر ما يمكن ، وتركيز النواتج أقل مايمكن .
بمرور الزمن يقل تركيز المتفاعلات ،يزداد تركيز النواتج.
في نهاية التفاعل يصبح تركيز المتفاعلات أقل مايمكن ، وتركيز النواتج أكبر مايمكن.
قياس سرعة التفاعل الكيميائي :
عمليًا بمعدل اختفاء المواد المتفاعلة (النقص في تركيز المتفاعلات) أو ظهور احدي المواد الناتجة (زيادة في تركيز النواتج) مثال :
2NaOH +CuSO4 Na2SO4+Cu(OH)2
العوامل المؤثرة علي سرعة التفاعل الكيميائي :
1) طبيعة المتفاعلات 2) تركيز المتفاعلات 3) درجة حرارة التفاعل 4) العوامل الحفازة و الانزيمات
1) طبيعة المتفاعلات :
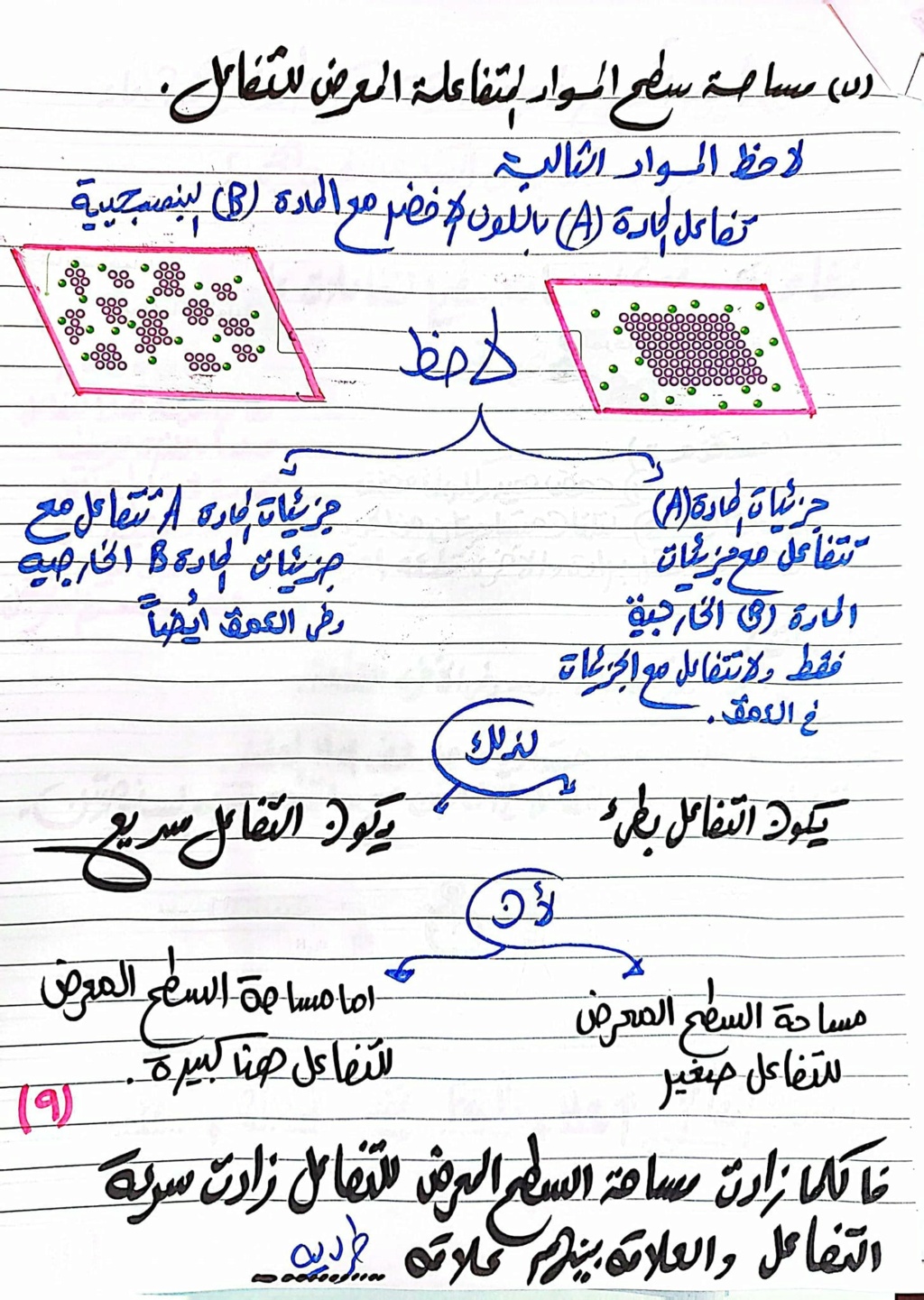
يقصد بطبيعة المتفاعلات { نوع الترابط في جزيئات المواد المتفاعلة_مساحة سطح المواد المتفاعلة المعرضة للتفاعل}
نوع الترابط : حيث في المركبات الأيونية تفاعلاتها سريعة وذلك لأنها تتفكك كليًا عند ذوبانها في الماء.
أما المركبات التساهمية تفاعلاتها معظمها بطئ وذلك لأنها يصعب تأينها عند ذوبانها في الماء.
مساحة سطح المواد المتفاعلة المعرض للتفاعل : عندما تكون المواد المتفاعلة علي هيئة قطعة كبيرة الحجم فيكون التفاعل بطئ لأن مساحة السطح صغيرة.
عند تفتيت المادة علي هيئة برادة أو مسحوق يكون التفاعل سريع لأن مساحة السطح كبيرة.
2) تركييز المتفاعلات :
عند زيادة تركيز المتفاعلات يزداد عدد التصادمات المحتملة بين الجزيئات وبالتالي تزداد سرعة التفاعل الكيميائي.
Mg+ 2HCl MgCl +H2
3) أثر درجة الحرارة علي سرعة التفاعل الكيميائي:
تزداد سرعة التفاعل الكيميائي بزيادة درجة حرارة التفاعل.
4) العوامل الحفازة :
مادة كيميائية تغير من معدل التفاعل الكيميائي.
أنواع تفاعلات الحفز:
تفاعلات الحفز الموجب: تفاعلات كيميائية يقوم فيها العامل الحفاز بزيادة سرعتها.
تفاعلات الحفز السالب: تفاعلات كيميائية يقوم فيها العامل الحفاز بخفض سرعتها.
خواص العامل الحفاز:
1) يغير من سرعة التفاعل ولكن لايؤثر علي بدء أو ايقاف التفاعل.
2) تكفي منه كمية صغيرة لاتمام التفاعل.
3) يرتبط أثناء التفاعل بالمواد المتفاعلة وسرعان ما ينفصل عنها بعد تكوين النواتج.
4) يقلل من الطاقة اللازمة لحدوث التفاعل الكمياءي .
الانزيمات:
مواد كيميائية ينتجها جسم الكائن الحي تعمل كعوامل حفازة تزيد من سرعة التفاعلات الحيوية.
تتم التفاعلات البيولوجية : في وجود الانزيمات بسرعة تفوق الاف أو ملايين المرات في عدم وجودها.
يؤدي كل انزيم وظيفة واحدة محددة : مثال : تحتوي البطاطا علي انزيم الاوكسيديز الذي يزيد من سرعة تفكك فوق أكسيد الهيدروجين الي ماء وغاز الاكسجين.
العلم و التكنولوجيا والمجتمع: المحول الفحري: علبة معدنية توجد في السيارات الحديثة لمعالجة الغازات الضارة الناتجة عن احتراق الوقود قبل طردها.
التركيب : يتركب من ثلاث شعب كل منها عبارة عن خلايا مصنوعة من الخزف أو السيراميك تشبه خلايا شمع النحل مطلية بطبقة رقيقة من عامل حفاز كالبلاتين أو البلاديوم ويتصل المحول الحفزي بأنبوب لطرد غازات عوادم الاحتراق.
الاهمية : تقوم كل شعبة من الشعب الثلاث بمعالجة واحد من الغازات الضارة الناتجة عن احتراق الوقود في المحرك قبل طردها للحد من التلوث البيئي .
فكرة العمل : العوامل الحفازه :تزيد من سرعة تفاعلات معالجة غازات الاحتراق الضارة.
الخلايا السيراميكية المشابهه لخلايا شمع النحل تعمل علي زيادة مساحة السطح المعرض لتيار الغازات المنبعثة من المحرك مما يحقق أكبر وفر في استخدام المعادن الثمينة.
استخدامات بيكربونات الصوديوم في الحياة اليومية :
1) في المنزل: مثل اضافتها ل كيس المكنسة الكهربائية للتخلص من رائحة التراب التي تظهر أثناء التنظيف.
2) في تلميع المعادن حيث تعيد للقطع المعدنية المصنوعه من النحاس أو الكروم رونقها.
3) في الحديقة: توضع في أماكن خروج النمل مما تعمل علي اختفاؤه.