مراجعة كل مسائل منهج الكيمياء للثانوية العامة
شاهد ايضا|
مراجعة كيمياء ثالثة ثانوي مستر محمد نايفمراجعة قوانين الكيمياء للصف الثالث الثانوى أ/ سليمان الحكيم
ملخص الكيمياء التحليلية للصف الثالث الثانوي مستر/ مينا عطية
نماذج امتحانات كيمياء الصف الثالث الثانوى 2021 نظام حديث بالاجابات

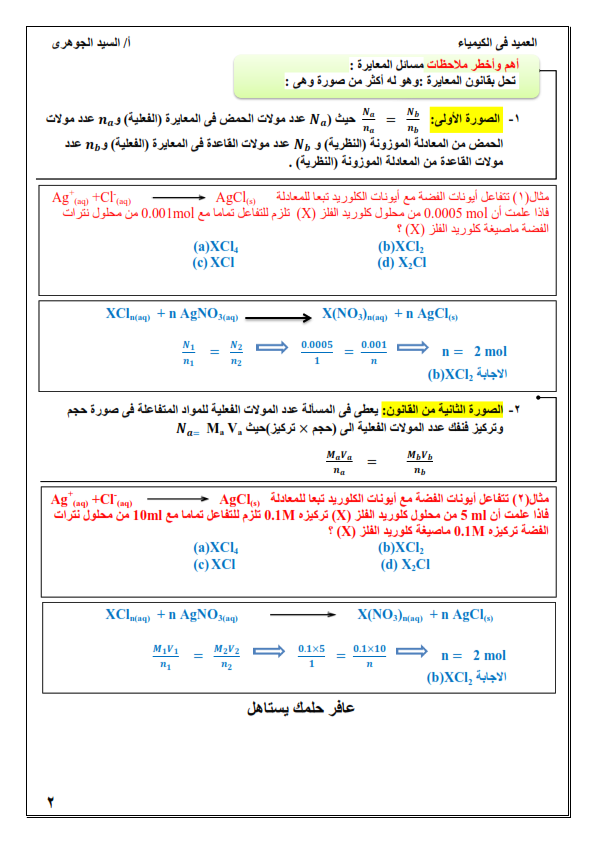
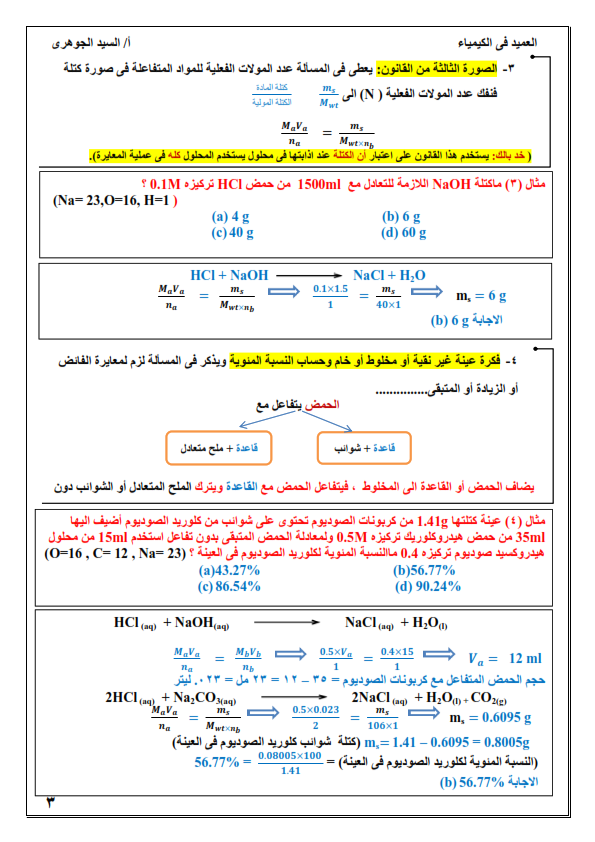
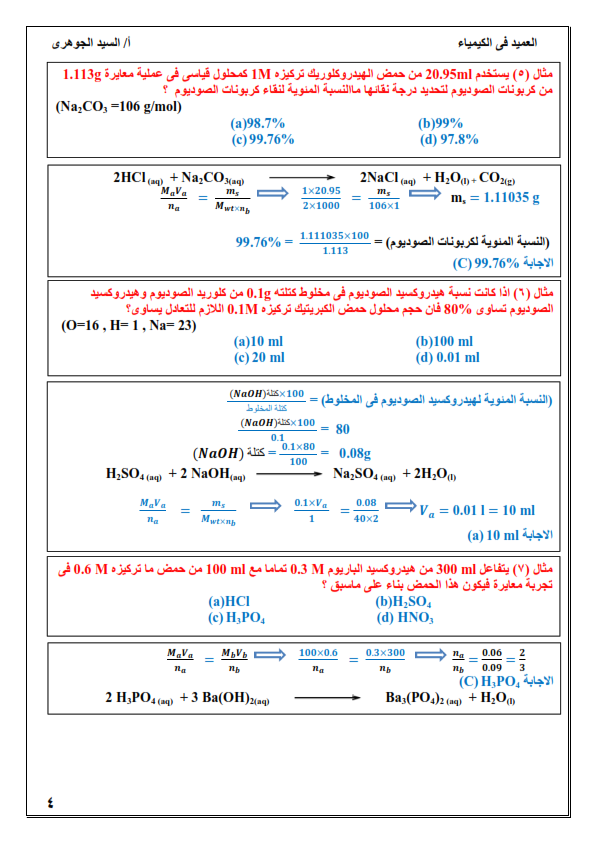
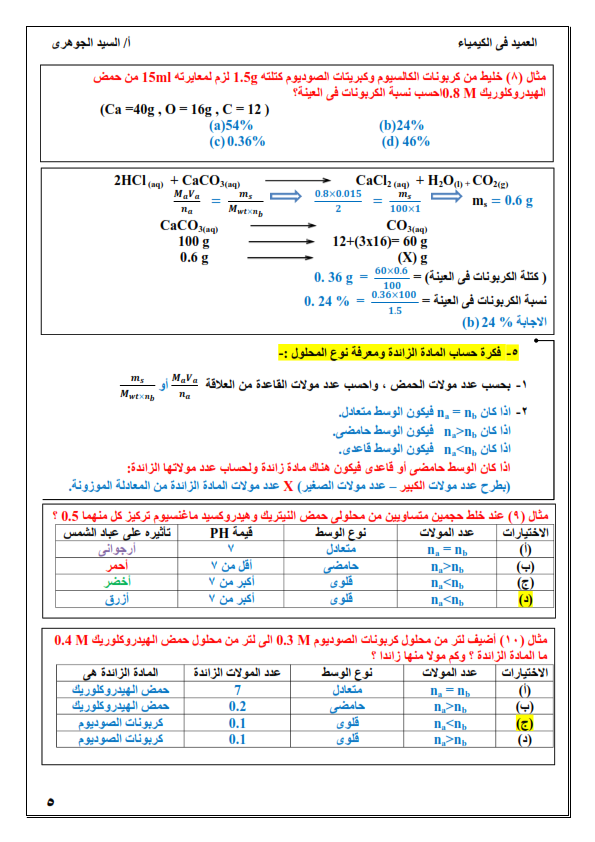










1. الكيمياء التحليلية: هي أحد فروع علم الكيمياء تهتم بالمادة من ناحيتين الكمية والنوعية.
2. التحليل الكيفي: هو الفرع من التحليل الذي يعني بالتعرف على التركيب الكيميائي لنوعية المادة دون التعرض لتعيين كميتها.
3. الملح: هو مركب يتكون من شقين قاعدي والآخر حمضي.
4. الشق القاعدي: هو الأيون الموجب للفلز أو مجموعة الامونيوم.
5. الشق الحمضي: هو الأيون السالب للملح وقد يكون لذرة أو مجموعة ذرات.
6. التميؤ: هو تفكك المركب إلى أيونات موجبة وسالبة عندما ينحل في الماء.
7. المجموعة التحليلية: هي مجموعة حمضية أو قاعدية تحمل شحنة كهربية سالبة أو موجبة.
8. كشف اللهب: هو الكشف الجاف للملح حيث تضفي الشقوق القاعدية للملح ألوان
أهم القوانين للحسابات الكيميائية:
1- الوزن بالجرام = عدد المولات × الكتلة الجزيئية .
2- عدد المولات = الوزن بالجرام / الكتلة الجزيئية .
في حالة حساب عدد المولات لذرة معينة مثل Na نستبدل الكتلة الجزيئية في القانون ( 2 ) : بالكتلة الذرية .
* من خلال مثلث العلاقات الثاني يمكننا معرفة القوانين الآتية :
1- عدد ( الذرات أو الأيونات أو الجزئيات ) = عدد المولات × عدد أفوجادرو .
2- عدد المولات = عدد ( الذرات أو الأيونات أو الجزئيات ) / عدد أفوجادرو .
عدد أفوجادرو = 23اس6.02 × 10
* إضافات أخرى :
1- المولارية = عدد مولات المذاب / حجم المحلول باللتر .
ولذلك يمكن حساب عدد المولات بدلالة المولارية كالآتي :
2- عدد المولات = المولارية × الحجم باللتر .
3- الكتلة الذرية الجرامية = الكتلة الذرية (( بوحدة الجرام )) .
4- الكتلة الجزيئية الجرامية = الكتلة الجزيئية (( بوحدة الجرام )) .
* المول : هو كمية المادة التي تحتوي على عدد أفوجادرو من أي صنف من الوحدات
( ذرات أو أيونات أو جزئيات ) .
* الكتلة الجزيئية : هي مجموع كتل الذرات المكونة للجزئ .
* المعادلة الكيميائية الموزونة هي أساس الحسابات الكيميائية .
لذا عليك الاهتمام بالمعادلات الكيميائية ووزنها وذلك لن يتم إلا من خلال حفظ رموز العناصر وتكافؤاتها وصيغ الشقوق وتكافؤاتها
* نقول عن الكتلة ( وزن ) تجاوزاً . **
* 1 كجم = 1000 جم (( كتلة )) . الكيميائية .
* 1 ل = 1000 ملل = 1000 سم3 . (( حجم ))
* 1 ملل = 1 سم3 .
: مصطلحات كيميائية:
الاكسدة:
عملية يتم فيها فقد الالكترونات.
الاختزال :
عملية يتم فيها اكتساب الالكترونات.
العامل المؤكسد:
المادة التي تكتسب الكترونات.
العامل المختزل :
المادة التي تفقد الكترونات.
عدد التأكسد :
هو العدد الذي يمثل الشحنة الكهربائية ( الموجبة او السالبة ) التي تحملها ذرة العنصر في المركبات الكيميائية ( الايونية او التساهمية).
القوة الدافعة الكهربائية للخلايا الغلفانية:
هي القوة التي تسبب حركة الالكترونات وانتقالها في السلك الموصل بين قطبي الخلية.
الاستاذالجمعة 24 يونيو 2022, 9:32 am