برشامة ليلة الامتحان.. كيمياء للثانوية العامة 2024.. وأهم النقاط التى يجب التركيز عليها
الباب الاول
السلسلة الانتقالية الاولى عبارة عن 10 صفوف رأسية مقسمه 8 مجموعات وتم جمع الحديد والنيكل والكوبلت فى مجموعه واحده (عناصر المجموعةالثامنة) وذلك لتماثل أنصاف أقطارها
علل: المجموعةالثامنة هي الوحيدة التى لم تأخذ حرف (B)
جـ: لتميزها عن باقى عناصر السلسلة فى تماثل أنصاف الأقطارها.
تذكر أن: أعلى عدد تأكسد لأى عنصر لا يتعدى مجموعته يعنى رقم المجموعةهو الحد الاقصى لعدد تأكسده
ويشذ عن ذلك مجموعة واحدة المجموعة 1B))، يمكن أن نجد عدد تأكسد النحاس يتجاوز رقم (+2) تجاوز رقم المجموعة (1)
يمكن أن نجد عدد تأكسد الذهب (+3) تجاوز رقم المجموعة(1)
تختلف المجموعة الثامنة عن باقى مجموعات B فى أن عناصرها الأفقية أكثر تشابهاً من عناصرها الرأسية
المصطلح الوحيد في هذا الباب
احفظ استخدام واحد لكل عنصر انتقالي وسبيكة … تأتي في صورة أذكر، أو ذكر الاستخدام وإعطاء أربعة اختيارات تختار منهم العنصر المطابق للاستخدام المذكور بالسؤال
سؤال عن تعريفات الخواص المغناطيسية والعنصر الانتقالي الذي له خواص مغناطيسية والعناصر الملونة في أسئلة الاختيارات
في هذا الباب نوعان من الافران:
أفران الاختزال (الفرن العالي – فرن مدركس)
أفران الانتاج (الفرن المفتوح – الفرن الكهربي – المحول الأكسجيني)
ثلاثة مقارنات لابد من حفظهم جيداً (لازم واحدة في الامتحان)
1. مقارنه بين الفرن العالى و فرن مدركس
2. مقارنه بين خامات الحديد ماجنيت، هيماتيت، ليمونيت، سدريت من حيث اللون، الصيغه/ الاسم العلمى/ لا تحفظ النسب
3. مقارنه بين السبائك الثلاثة: قارن بين السبيكة البينية / السبيكة الاستبدالية / السبيكة البينفلزية
كلمة الصلب موجودة بثلاثة أنواع من السبائك:
حديد صلب = سبيكة بينية (عبارة عن حديد وكربون )
صلب لا يصدأ = سبيكة استبدالية ( عبارة عن حديد وكروم)
صلب كربونى (فى دليل التقويم)= (سيمنيت Fe3C) في (كتاب مدرسى)
نركز على فى سبائك خارج التصنيف وهما نوعان:
1. سبيكة البرونز = نحاس وقصدير
2. سبيكة النحاس الأصفر= نحاس وخارصين
يتفاعل الحديد مع عنصرين لا فلزين (الكلور، الكبريت)
الحديد مع الكلور(لافلز) = كلوريد الحديدII (علل) لأن الكلور عامل مؤكسد قوي
الحديد مع الكبريت (لافلز) = كبرتيد الحديد II (علل) لأن الكبريت عامل مؤكسدة ضعيف
عندما يطلب الحصول على الحديد من أي نوع من أكاسيد الحديد (أكسيد حديدII / أكسيد حديد III/ أكسيد حديد مغناطيسى)
يمكن تحول جميع أكاسيد الحديد إلى حديد بإحدى الطريقتين:
- التسخين مع الهيدروجين (عامل مختزل)
- التسخين مع أول اكسيد الكربون (عامل مختزل) بشرط أن تزيد الحرارة عن 5700م
للتحويلات
مبتدأً بـ ـ: كبريتات حديد/ كربونات حديد/ اوكسالات حديد/هيدروكسيد حديد… نسخن أولاً وبعدها نأخذ المادة الناتجة نكمل بها
مبتدأً بـ: بكلوريد الحديد تحول الى هيدروكسيد حديد
يعنى مبتدأً بكلوريد الحديد III كيف تحصل على هيدروكسيد حديد
يتم تفاعل كلوريد الحديد III مع هيدروكسيد صوديوم أو هيدروكسيد أمونيوم فيتحول إلى هيدروكسيد حديد III بعدها تسخين
س: ما هو الاساس العلمى لصناعة الصلب
تعتمد صناعة الصلب على عمليتين هما :
1. التخلص من الشوائب الموجودة فى الحديد الناتج من أفران الاختزال.
2. إضافة بعض العناصر إلى الحديد لتكسب الصلب الناتج الخواص المطلوبة
الباب الثاني
المنهج كله من باب الأول إلى الخامس يوجد 6 أساس علمى
1. ما هو الاساس العلمى لصناعة الصلب (باب اول)
2. أساس الكشف عن الشقوق الحامضية (باب ثانى)
3. أساس الكشف عن الشقوق القاعدية (باب ثانى)
4. أساس طريقه التطاير
5. أساس طريقه الترسيب
6. أساس صناعه المنظفات الصناعية (معالجه مركبات حمض السلفونيك الاروماتية بالصودا الكاوية)
سؤال يربط بين الباب الثانى والباب الرابع (الامتحان التجريبى 2016)
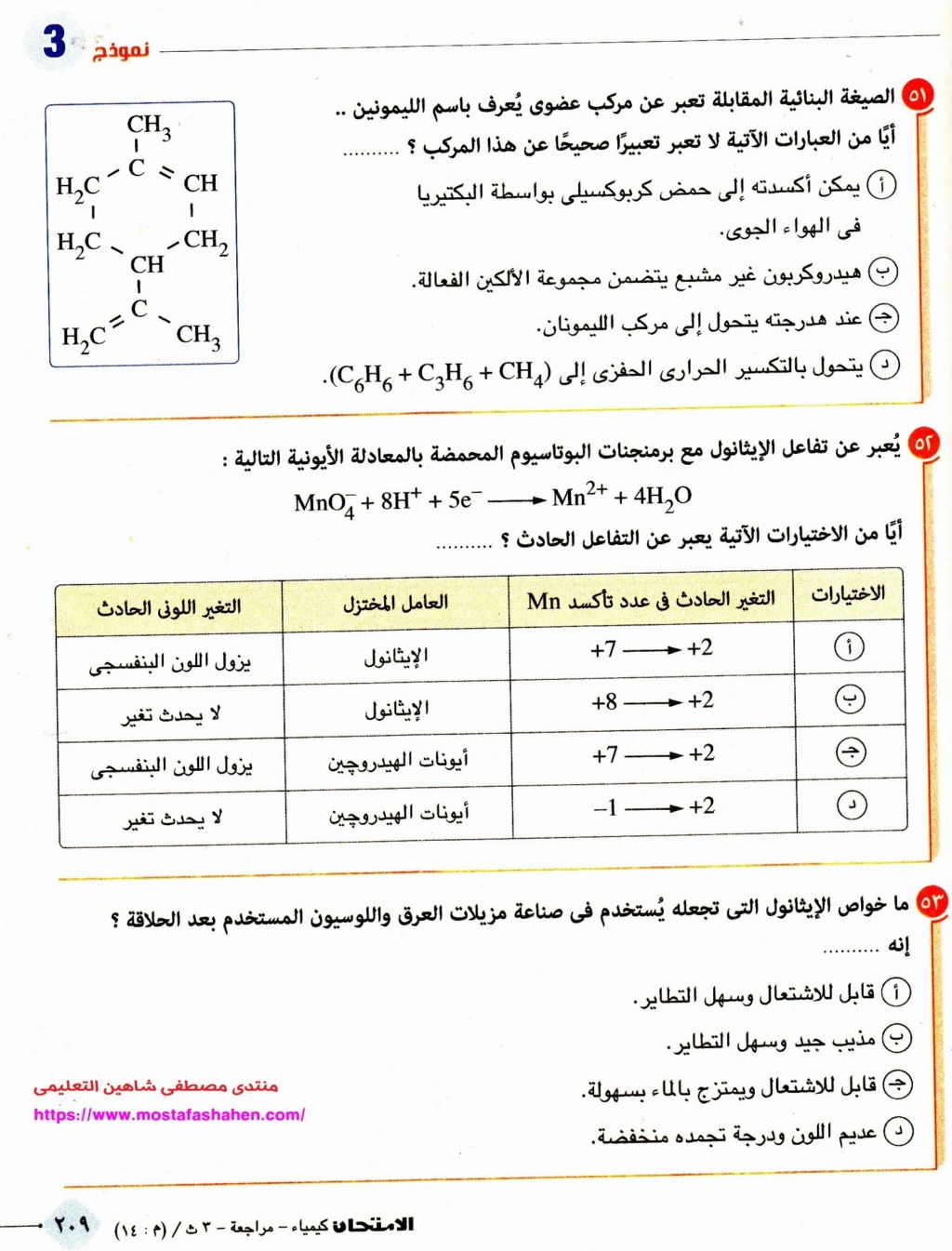
س: باستخدام محلول يوديد البوتاسيوم كيف يمكن التعرف على الأنود والكاثود فى بطارية مطموسة المعالم (غير واضحة الأقطاب)
جـ: لا يختلط عليكم أن هذا سؤال كهربية لكنه سؤال كشف عن أيون اليوديد التابع لمجموعة حمض الكبرتيك المركز (باب ثاني)
فنقوم بتوصيل محلول يوديد البوتاسيوم ببطارية السيارة فنلاحظ ان أيون اليوديد السالب يحدث له أكسدة وتتصاعد أبخرة اليود ويتصاعد عند القطب الموجب الكاثود (خلية جلفانية) وهو الذى تتصاعد عنده ابخرة اليود البنفسجية بالتالى القطب الثاني هو القطب السالب (الأنود)
الجزء الثانى:
مسائل حساب النسبه المئوية، دائماً أول كتله تعطى في هذه المسائل هي الكتلة الكلية
س: ما هى انواع التفاعلات التى تستخدم فيها عملية المعايرة ؟
جـ: المعايرة لا تحدث إلا فى 3 أنواع من التفاعلات هي تفاعلات (التعادل، الأكسدة والاختزال ، الترسيب)
العمليات العكسية في المنهج بالكامل هما عمليتان عكس بعض
(1) عملية التعادل عكس عمليه التميؤ.
(2) عملية البلمرة عكس عملية التكسير الحرارى الحفزى فى الكيمياء العضويه.\
الباب الثالث
وردت كلمة الاتزان 4 مرات 3 لهم تعريف والرابعة تعريفها من واقع الامتحانات
1. نظام متزن: نظام ساكن على المستوى المرئي وديناميكي على المستوى غير المرئي
2. الاتزان الكيميائى: نظام ديناميكي يحدث عندما يتساوى معدل التفاعل الطردي مع معدل التفاعل العكسي بحيث تثبت تركيزات المتفاعلات والنواتج ( ويظل الاتزان قائماً طالما كانت جميع المواد المتفاعلة والناتجة موجودة في حيز التفاعل ولم يتصاعد غاز أو يكون راسب وما دامت ظروف التفاعل كدرجة الحرارة والضغط ثابتة)
3. الاتزان الايونى: الاتزان الناشئ في المحاليل الإلكتروليتية الضعيفة بين جزيئاتها والأيونات الناتجة عنها
4. حاله الاتزان: الحالة التي يتساوى عندها تركيز المتفاعلات وتركيز النواتج أو الحالة التي يتساوى عندها معدل التفاعل الطردي والعكسي
وعندنا خمسة مقارانات
1. الإلكتروليتات القوية والإلكتروليتات الضعيفة
2. التفاعلات التامة وغير التامة
3. الاتزان الكيميائى والاتزان الايونى
4. التأين التام و التأين الضعيف
5. التعادل والتميؤ
الباب الثالث لا يوجد به غير نوعين من العوامل (س: ما نوع العوامل…)
1. عوامل تؤثر على سرعة التفاعل
طبيعة المواد المتفاعلة
تركيز المواد المتفاعلة
درجة حرارة التفاعل
الضغط
العوامل الحفازة
الضوء
2.عوامل تؤثر على الاتزان الكيميائى (لوشاتليه)
تركيز المواد المتفاعلة
الضغط الخارجي
درجة حرارة التفاعل
س: فى النظام المتزن التالى…. ما أثر زيادة الضغط - التركيز - الحرارة
ولكن إذا ذكر مؤثر غير هؤلاء الثلاثة من قاعدة لوشاتليه ، فقال مثلاً:
س: ما أثر إجراء التفاعل التالى فى إناء أصغر حجماً؟ اللى مش فاهم هيقول الحجم لا يؤثر (عامل غير عوامل لوشاتيليه )
)
تذكر مثال البلونة المنفوخة عند محاولة تقليل حجمها بالضغط عليها ما سيحدث لها؟
جـ: انفجار لماذا؟؟ لزيادة الضغط.
إذاً فى سؤال لوشاتلييه يمكن زيادة الضغط عن طريق تقليل حجم الوعاء (انتقاص حجم الوعاء) فيترتب عليه زيادة الضغط
ولاحظ أن: لا يكون للضغط أثر على اتزان التفاعل الكيميائي إلا إذا كانت جميع المتفاعلات والنواتج غازات
بمعنى: لو كان المعادله التفاعل تتم على محاليل (aq) ، فإن الضغط ليس له تأثير فهو يؤثر إلا فى التفاعل كله غازات (g) يعني المعادله من أولها لأخرها تحتها حرف (g)..، لكن لو التفاعل في المعادلة بين عدة غازات وكان وبينهم سائل واحد فليس للضغط أثر على التفاعل
التجارب عندك فى المنهج سبعة تجارب لازم في الامتحان سؤال اشرح (تجربه عمليه)
1. تجربه اثر مساحه السطح
2. تجربة قانون فعل الكتله (الخاص بالتركيز)
3. تجربه توضح أثر درجة الحرارة
4. تجربة تحقيق قانون إستدفالد (الخاص بالتخفيف)
5. تجربة قانون فاراداي الاول والثانى
6. تجربة الكشف عن الكربون والهيدروجين (عضوية)
7. تجربة اختبار تعاطى السائقين للمشروبات الكحولية (تغير لون ماده السليكا جيل من هواء الزفير للشخص المتعاطي المشروبات الكحولية).
فى الباب الثالث 6 ثوابت اتزان
1. ثابت اتزان المحاليل Kc
2. ثابت اتزان الغازات Kp
3. ثابت تأين الحمض Ka
4. ثابت تأين القاعدةKb
5. الحاصل الأيوني للماء Kw
6. حاصل الإذابة Ksp
لازم تعرف متى تكتب Kc ومتى تكتب Kp ؟
إذا أعطيت المسألة التراكيز بالمولاية (مول/ لتر) فيستخدم ثابت اتزان المحاليل Kc
إذا أعطيت المسألة التراكيز بالضغط الجزيئي أو الضغط الجوي فيستخدم ثابت اتزان الغازات Kp
أهم المسائل مسائل حاصل الإذابة؟ لماذا؟ لأن قانون حاصل الإذابة يكتب بدلالة التركيز وإما بدلالة درجه الإذابة.
عندما يذكر في المسألة بدلالة التركيز تستخدم العلاقة التقليدية Ksp = [Ab+]a[Ba-]b
عندما يذكر في المسألة بدلالة درجة الإذابة تستخدم العلاقة Ksp= [ax]a [bx]b
مثال: احسب حاصل الإذابة Ksp لملح فوسفات الكالسيوم Ca3(PO4)2 علماً بأن تركيز أيون الكالسيوم 2× 10-8 مولار وتركيز ايون الفوسفات
1×10-3 مولار
الحل
=3Ca2+(aq) +2PO43-(aq) (s) Ca3(PO4)2
Ksp =[Ca2+]3 [PO43-]2
= (2×10-8)3×(1×10-3)2
= 8×10-3
مثال: احسب حاصل الإذابة Ksp لملح فوسفات الكالسيوم PbBr2 علماً بأن درجة إذابته 1,04×10-2 مولار
الحل
PbBr2(s) = Pb2+(aq)+2Br-(aq)
xM 2xM
Ksp= [x] [2x]2
=(1.04×10-2)×(2×1.04×102-)2= 4.5×106-
يوجد قاعدتين وخمسة قوانين فى المنهج لازم في الإمتحان قانون ولازم قاعدة
المنهج قاعدتين فقط
1. قاعدة لوشاتليه ( كيمياء غير عضويه)
2. قاعدة ماركونيكوف (كيمياء عضويه)
يتبقى عندك خمسة قوانين لازم يأتى القانون إما مصطلح إما مفهوم علمى
1. قانون فعل الكتله
2. قانون استفالد
3. قانون فراداء الاول
4. قانون فراداء الثانى
5. القانون العام للتحليل الكهربى
تعريف التميؤ: هو ذوبان الأملاح فى الماء لتكوين الحمض والقاعدة اللذان اشتقا منهما الملح
لاحظ أن: في درس التميؤ ذكر فى كتاب المدرسه التميؤ لأربعة أملاح ولكن ينطبق معنى التميؤ على حاله واحدة فقط، فليس كل ذوبان تميؤ
شرط الذوبان أن يكون تميؤ لابد أن ينتج من ذوبان الملح (حمض ضعيف أو قلوى ضعيف أو الاثنين حمض وقلوي معاً)
علل: لا يعتبر ذوبان كلوريد الصوديوم فى الماء تميؤ
جـ: لأن ناتج التميؤ هيدروكسيد الصوديوم وحمض الهيدروكلوريك وكلاهما قلوى وحمض قويان
تحدث كتاب المدرسة عن تأثير محلول (كربونات الصوديوم، كلوريد الأمونيوم، أسيتات الأمونيوم، كلوريد الصوديوم) على ورقة عباد الشمس ولم يذكر هيدروكسيدات العناصر الانتقالية .
اعلم أن:جميع هيروكسيدات العناصر الانتقالية قلويات ضعيفة .
س: ما أثر ملح كلوريد الحديد III على ورقه عباد الشمس ؟
( نحاس – الحديد -كروم – خارصين – نيكل…) عناصر انتقاليه والعنصر الانتقالى أصله فلز يعطي أيونات موجبة ويتحد مع مجموعة الهيدروكسيد (في الماء) ويعطى (هيدروكسد العنصر الإنتقالي)
إذاً جميع هيدروكسيدات العناصر الانتقالية قلويات ضعيفة، إذاً محلول كلوريد الحديد III حمضى التأثير على ورقه عباد الشمس
الباب الرابع الكهربية
لديك خمس رسومات الأكثر تكراراً فى امتحانات الوزارة والنماذج والكتب الخارجية.
يأتى السؤال ارسم شكلا تخطيطيا مع كتابة البيانات أو يقول ارسم قطاعاً مع كتابة البيانات
1. خلية دانيال
2. قطب الهيدروجين القياسى
3. خلية الزئبق
4. خليه الوقود
5. المركم الرصاصى
تذكر في خلية دانيال: لازم تعرف تفاعل الأنود /تفاعل الكاثود /التفاعل الكلى /الرمز الاصطلاحي / القنطرة الملحية ومعرفة تركيبها وشرط محلولها/ أسباب توقف التيار
تذكر في خلية دانيال: أنود الخارصين مغمور في محلول كبريتات الخارصين، كاثود النحاس مغمور في محلول كبريتات نحاس.
علل: فى الخلايا الجلفانية ينغمس القطب فى محلول يحتوى على أيوناته؟
جـ: لرفع جهد الأكسدة لقطب الأنود ورفع جهد الاختزال لقطب الكاثود
لاحظ أن قطب الهيدروجين القياسى بدأ بسلك من البلاتين ولم ينتهى بسلك ولكن انتهى بصفيحه من البلاتين!
علل: ينتهى سلك البلاتين فى قطب الهيدروجين القياسى بصفيحه من البلاتين الاسفنجى ولم تصنع كلها من سلك بلاتين؟
جـ: لزيادة مساحة السطح المعرض للتفاعل بالتالى زيادة سرعه التفاعل
أهم الموضوعات التى أضيفت لمنهج 2016
ميكانيكية صدأ الحديد
وضح بالمعادلات أو وضح ميكانيكيه أو وضح خط سير أو وضح خطوات صدأ الحديد
نكتب الاربع معدلات ونجمعهم
تفاعلات صدأ الحديد
2Fe(s) 2Fe+2(aq) + 4e-
2H2O(ℓ) + O2(g) + 4e- 4OH –(aq)
2Fe+ + 4OH- 2Fe(OH)2(aq)
2Fe(OH)2(aq) +½ O2(g) + H2O(l) 2 Fe(OH)3(S)
بجمع المعادلات تصبح المعادلة الكلية لتفاعل خلية تآكل الحديد هي:
2Fe (s) +3H2O(l)+ 3/2 O2(g) 2 Fe(OH)3(S)
علل: تفاعل الصدأ من التفاعلات البطيئة .
جـ: لاحتواء الماء على كميات محدودة من الأيونات .
علل: يكون صدأ الحديد أسرع فى ماء البحر عن الماء العادى .
جـ: لأن ماء البحر يحتوى كميات أكبر من الأيونات بينما الماء العادى يحتوى كميات محدودة من الأيونات .
س: صدأ الحديد عباره عن:
1. أكسيد حديدII
2. أكسيد حديدIII
3. هيدروكسيد حديدII
4. هيدروكسيد حديد III
جـ:(4)
يوجد بالكيمياء الكهربية أربع مقارنات أساسية:
1. الخلايا التحليليه (الالكتروليتية أو خلايا التحليل الكهربى) وبين الخلايا الجلفانية
2. مقارنه بين الخلايا الأولية والخلايا الثانوية
3. الغطاء الأنودي والغطاء الكاثودي
4. أو اثنين من الاربع خلايا الجلفانية (اللثيوم والوقود والزئبق والسيارة) ، اللثيوم والسيارة / اللثيوم والزئبق / الوقود والزئبق / الوقود والسيارة.
يوجد ثلاثة تطبيقات هامه في الكيمياء الكهربية …وضح بالرسم مع كتابة البيانات كيف يمكن (3درجات)
1. طلاء إبريق (ملعقة) من النحاس بطبقه من الفضه حدد القطب الذي يتم توصل به (المشغولة) والقطب الذي يوصل به المادة المراد الطلاء بها
وأيونات المادة (المحلول الالكتروليتى) التي سيتم بها الطلاء فى حوض الطلاء ؟؟
2. وضح بالرسم التفاعلات الحادثه عند الأقطاب مع رسم الفرن ومعادلة الأنود والكاثود والتفاعل الكلي لاستخلاص الألومنيوم في الصناعة
3. وضح بالرسم مع كتابة البيانات كيف يمكن تنقية ساق نحاسيه من الشوائب.
مسألة الكيمياء الكهربية سيطلب حساب القوه الدافعه الكهربية يطلب فيها تحديد نوع الخليه وكيفية التعرف على نوع الخلية؟
قانون القوه الدافعه الكهربية يكتب بإحدى الطرق الآتية:
1. لو أعطى 2 جهد اختزال نأخذ جهد الاختزال الكبير (الكاثود) – جهد الاختزال الصغير (الأنود)
2. لو أعطى 2 جهد أكسده نأخذ جهد الأكسدة الكبير (الأنود) – جهد الأكسدة الصغير (الكاثود)
3. لو أعطى جهد أكسده واختزال نأخذ جهد أكسدة الأنود + جهد إختزال الكاثود
ونتعرف على نوع الخلية من إشارة القوة الدافعة الكهربية
1. (موجبة+) الخليه جلفانية ونوع التيار تلقائى والتفاعل تفاعل تفريغ
2. (سالبة-) الخليه تحليليه ( خلية تحليل كهربى) ونوع التيار غير تلقائى والتفاعل تفاعل شحن
السلسلة الكهروكميائية (سلسة الجهود أو متسلسلة الجهد الكهربية أو متسلسلة النشاط الكيميائى)
لا يوجد مصطلح يبدأ بكلمة ترتيب غير السلسلة الكهروكميائية ويأتى كما يلي:
رتب العناصر الآتية تصاعدياً كعوامل مختزلة … خلي بالك (العامل عكس العملية) يعني:
1. العنصر الذى تحدث له عمليه أكسده فهو عامل مختزل و العنصر الذى تحدث له عمليه اختزال فهو عامل مؤكسد
2. الترتيب كعوامل مختزله اذاً الترتيب فذلك حسب جهود الأكسدة
3. الترتيب كعوامل مؤكسده اذاً الترتيب حسب جهود الاختزال
الباب الخامس العضوية
عندى فى المنهج ثلاثة أجهزه فى المعمل والسؤال عليه 3( درجات)
السؤال يأتى اشرح مع رسم الجهاز المستخدم وكتابة معادلة التفاعل (لازم جهاز فى الامتحان)
1. جهاز تحضير الميثان فى المعمل
2. جهاز تحضير الإيثين (الإيثيلين) فى المعمل
3. جهاز تحضير الايثاين(الإستيلين) فى المعمل
أهم 13 نقطه هم أساس الكيمياء العضوية تأتي في صورة سؤال ما الفرق بين أو قارن بين…
1. المركبات العضوية وغير العضويه
2. الصيغه الجزئية والصيغة البنانيه
3. النفثالين و ثنائى الفينيل
4. الهيدرة الحفزيه للإيثين والإيثاين
5. التحلل الحرارى والتحلل المائى لكبريتات الإيثيل الهيدروجينية
6. المركبات الأليفاتية (الدهنية) والمركبات الأروماتية (العطرية)
7. التسميه الشائعة للكحولات والأحماض
8. تفاعل الايثانول مع حمض الكبرتيك المركز.
9. البلمره بالإضافة والبلمرة بالتكاثف مع ذكر مثال
10. التكسير الحرارى للأوكتان (بيوتان وبيوتين) ، التحلل المائى للسكر (جلوكوز وفركتوز)
11. حالات تحلل للاسترات الثلاثة (مائى حمضى- مائى قاعدي - نشادرى)
12. التصبن والتصلب
13. نيترة الطولوين ونيترة الفينول
توضيح بعض الحالات
في حالة(7) التسميه الشائعة للكحولات والأحماض لاحظ أن كتاب المدرسه لم يشرح التسمية الشائعة إلا فى موضعين (الكحولات والأحماض)
س: ما الفرق بين التسمية الشائعة للكحولات وللأحماض فى الكربوكسيلية؟
س: ما المقصود بالتسمية الشائعة للأحماض العضوية
التسميه الشائعة للكحولات بيكون حسب مجموعه الاكيل C2H5OH سمي كحول إيثيلي تبعاً لمجموعة الإيثيل (C2H5-)
الأحماض الكربوكسيلية حسب مصدرها مثلا حمض الفورميك من الكلمه اللاتينيه فورميكا معناها (النمله) وحمض الأسيتيك من كلمة (Acetum) تعنى باللاتينى الخل
في حالة ( تفاعل الايثانول مع حمض الكبرتيك المركز عند 5180م يعطي (ألكين) إيثين، عند 5140م يعطي إثير ثنائي الإيثيل(الإيثير المعتاد)
تفاعل الايثانول مع حمض الكبرتيك المركز عند 5180م يعطي (ألكين) إيثين، عند 5140م يعطي إثير ثنائي الإيثيل(الإيثير المعتاد)
في حالة (12) (خطيرة) قارن بين التصبن والتصلب.
التصبن: تحلل المائى قلوى (قاعدى) للإستر ينتج عنه ملح الحمض العضوي الذى يدخل فى صناعة الصابون
التصلب: هدرجه الزيوت (زيوت نباتيه سائله غير مشبعة) إلى دهون صلبه مشبعة حيث يتم ضخ تيار من غاز الهيدروجين على الزيوت غير المشبعة فتتحول من صورة سائلة غير مشبعة إلى دهون صلبة مشبعة (المسلي(سمن) الصناعي)
نقاط هامة
من طرق تحضير الكحولات طريقة هيدرة الاكين فيتحول إلى كحول(أولي/ثانوي /ثالثي)
الإيثين هو الألكين الوحيد بالهيدرة الحفزية (إماهة حفزية) = كحول أولي
جميع الكحولات فى العضويه ذات روابط أحاديه (مشبعه)
س: أكتب الصيغه الكيميائيه لكحول غير ثابت وغير مشبع
جـ: لا يوجد بالمنهج كله (غيركحول فاينيل) يتحول إلى أسيتالدهيد
في حالة(13) مقارنه بين نيترة الطولوين ونيترة الفينول
أولا: النيترة يستخدم خليط النيترة (حمض النيتريك مركز 1:1 حمض الكبرتيك مركز) على المركب المطلوب نيترته (طولوين أو فينول)
نسبة (الطولوين 3:1 خليط النيترة) = ينتج ثلاثي نيتروطولوين TNT أو حمض البكريك على الترتيب
سؤال التمييز يأتى عادة بين ألكين، ألكان أو ألكاين، ألكان يعنى بين مركب مشبع و مركب غير مشبع
الإجابة نضيف ماده ملونه (برمنجنات البوتاسيوم أو ماء البروم)حيث يزول اللون مع المركب غير المشبع (ألكين أو ألكاين)
الكحولات مواد مترددة يعنى تسلك سلوك الاحماض وسلوك القواعد تعمل معادلتين:
مرة الأولى الكحول مع فلز الصوديوم يحل الصوديوم محل الهيدروجين وهنا الكحول يسلك سلوك الاحماض
المره الثانيه تفاعل الكحول مع حمض HCl فى وجود كلوريد الخارصين ينزع مجموعة OH من الكحول وهنا الكحول يسلك سلوك القواعد.
المنهج به ستة علماء لهم أهمية في سؤال أذكر دور عالم
1. أستفالد (إيجاد علاقة بين درجة تأين المحاليل الإلكتروليتية الضعيفة α ودرجة تخفيفها)
2. كيكولي (إثبات الصيغة البنائية للبنزين)
3. جولدبرج وفاج (قانون فعل الكتلة المعبر عن العلاقة بين سرعة التفاعل الكيميائي وتركيز المواد المتفاعلة)
4. فوهلر (محطم نظرية القوى الحيوية وإثبات إمكانية تحضير مركب عضوي بالمعمل من مواد غير عضوية)
5. ماركونيكوف (إضافة متفاعل غير متماثل HXإلى ألكين غير متماثل)
6. لوتشاتيلية (نظرية العوامل المؤثرة على نظام كيميائي متزن)
مبتدأً بـ ـ: كبريتات حديد/ كربونات حديد/ اوكسالات حديد/هيدروكسيد حديد… نسخن أولاً وبعدها نأخذ المادة الناتجة نكمل بها
مبتدأً بـ: بكلوريد الحديد تحول الى هيدروكسيد حديد
يعنى مبتدأً بكلوريد الحديد III كيف تحصل على هيدروكسيد حديد
يتم تفاعل كلوريد الحديد III مع هيدروكسيد صوديوم أو هيدروكسيد أمونيوم فيتحول إلى هيدروكسيد حديد III بعدها تسخين
س: ما هو الاساس العلمى لصناعة الصلب
تعتمد صناعة الصلب على عمليتين هما :
1. التخلص من الشوائب الموجودة فى الحديد الناتج من أفران الاختزال.
2. إضافة بعض العناصر إلى الحديد لتكسب الصلب الناتج الخواص المطلوبة
الباب الثاني
المنهج كله من باب الأول إلى الخامس يوجد 6 أساس علمى
1. ما هو الاساس العلمى لصناعة الصلب (باب اول)
2. أساس الكشف عن الشقوق الحامضية (باب ثانى)
3. أساس الكشف عن الشقوق القاعدية (باب ثانى)
4. أساس طريقه التطاير
5. أساس طريقه الترسيب
6. أساس صناعه المنظفات الصناعية (معالجه مركبات حمض السلفونيك الاروماتية بالصودا الكاوية)
سؤال يربط بين الباب الثانى والباب الرابع (الامتحان التجريبى 2016)
س: باستخدام محلول يوديد البوتاسيوم كيف يمكن التعرف على الأنود والكاثود فى بطارية مطموسة المعالم (غير واضحة الأقطاب)
جـ: لا يختلط عليكم أن هذا سؤال كهربية لكنه سؤال كشف عن أيون اليوديد التابع لمجموعة حمض الكبرتيك المركز (باب ثاني)
فنقوم بتوصيل محلول يوديد البوتاسيوم ببطارية السيارة فنلاحظ ان أيون اليوديد السالب يحدث له أكسدة وتتصاعد أبخرة اليود ويتصاعد عند القطب الموجب الكاثود (خلية جلفانية) وهو الذى تتصاعد عنده ابخرة اليود البنفسجية بالتالى القطب الثاني هو القطب السالب (الأنود)
الجزء الثانى:
مسائل حساب النسبه المئوية، دائماً أول كتله تعطى في هذه المسائل هي الكتلة الكلية
س: ما هى انواع التفاعلات التى تستخدم فيها عملية المعايرة ؟
جـ: المعايرة لا تحدث إلا فى 3 أنواع من التفاعلات هي تفاعلات (التعادل، الأكسدة والاختزال ، الترسيب)
العمليات العكسية في المنهج بالكامل هما عمليتان عكس بعض
(1) عملية التعادل عكس عمليه التميؤ.
(2) عملية البلمرة عكس عملية التكسير الحرارى الحفزى فى الكيمياء العضويه.\
الباب الثالث
وردت كلمة الاتزان 4 مرات 3 لهم تعريف والرابعة تعريفها من واقع الامتحانات
1. نظام متزن: نظام ساكن على المستوى المرئي وديناميكي على المستوى غير المرئي
2. الاتزان الكيميائى: نظام ديناميكي يحدث عندما يتساوى معدل التفاعل الطردي مع معدل التفاعل العكسي بحيث تثبت تركيزات المتفاعلات والنواتج ( ويظل الاتزان قائماً طالما كانت جميع المواد المتفاعلة والناتجة موجودة في حيز التفاعل ولم يتصاعد غاز أو يكون راسب وما دامت ظروف التفاعل كدرجة الحرارة والضغط ثابتة)
3. الاتزان الايونى: الاتزان الناشئ في المحاليل الإلكتروليتية الضعيفة بين جزيئاتها والأيونات الناتجة عنها
4. حاله الاتزان: الحالة التي يتساوى عندها تركيز المتفاعلات وتركيز النواتج أو الحالة التي يتساوى عندها معدل التفاعل الطردي والعكسي
وعندنا خمسة مقارانات
1. الإلكتروليتات القوية والإلكتروليتات الضعيفة
2. التفاعلات التامة وغير التامة
3. الاتزان الكيميائى والاتزان الايونى
4. التأين التام و التأين الضعيف
5. التعادل والتميؤ
الباب الثالث لا يوجد به غير نوعين من العوامل (س: ما نوع العوامل…)
1. عوامل تؤثر على سرعة التفاعل
طبيعة المواد المتفاعلة
تركيز المواد المتفاعلة
درجة حرارة التفاعل
الضغط
العوامل الحفازة
الضوء
2.عوامل تؤثر على الاتزان الكيميائى (لوشاتليه)
تركيز المواد المتفاعلة
الضغط الخارجي
درجة حرارة التفاعل
س: فى النظام المتزن التالى…. ما أثر زيادة الضغط - التركيز - الحرارة
ولكن إذا ذكر مؤثر غير هؤلاء الثلاثة من قاعدة لوشاتليه ، فقال مثلاً:
س: ما أثر إجراء التفاعل التالى فى إناء أصغر حجماً؟ اللى مش فاهم هيقول الحجم لا يؤثر (عامل غير عوامل لوشاتيليه
تذكر مثال البلونة المنفوخة عند محاولة تقليل حجمها بالضغط عليها ما سيحدث لها؟
جـ: انفجار لماذا؟؟ لزيادة الضغط.
إذاً فى سؤال لوشاتلييه يمكن زيادة الضغط عن طريق تقليل حجم الوعاء (انتقاص حجم الوعاء) فيترتب عليه زيادة الضغط
ولاحظ أن: لا يكون للضغط أثر على اتزان التفاعل الكيميائي إلا إذا كانت جميع المتفاعلات والنواتج غازات
بمعنى: لو كان المعادله التفاعل تتم على محاليل (aq) ، فإن الضغط ليس له تأثير فهو يؤثر إلا فى التفاعل كله غازات (g) يعني المعادله من أولها لأخرها تحتها حرف (g)..، لكن لو التفاعل في المعادلة بين عدة غازات وكان وبينهم سائل واحد فليس للضغط أثر على التفاعل
التجارب عندك فى المنهج سبعة تجارب لازم في الامتحان سؤال اشرح (تجربه عمليه)
1. تجربه اثر مساحه السطح
2. تجربة قانون فعل الكتله (الخاص بالتركيز)
3. تجربه توضح أثر درجة الحرارة
4. تجربة تحقيق قانون إستدفالد (الخاص بالتخفيف)
5. تجربة قانون فاراداي الاول والثانى
6. تجربة الكشف عن الكربون والهيدروجين (عضوية)
7. تجربة اختبار تعاطى السائقين للمشروبات الكحولية (تغير لون ماده السليكا جيل من هواء الزفير للشخص المتعاطي المشروبات الكحولية).
فى الباب الثالث 6 ثوابت اتزان
1. ثابت اتزان المحاليل Kc
2. ثابت اتزان الغازات Kp
3. ثابت تأين الحمض Ka
4. ثابت تأين القاعدةKb
5. الحاصل الأيوني للماء Kw
6. حاصل الإذابة Ksp
لازم تعرف متى تكتب Kc ومتى تكتب Kp ؟
إذا أعطيت المسألة التراكيز بالمولاية (مول/ لتر) فيستخدم ثابت اتزان المحاليل Kc
إذا أعطيت المسألة التراكيز بالضغط الجزيئي أو الضغط الجوي فيستخدم ثابت اتزان الغازات Kp
أهم المسائل مسائل حاصل الإذابة؟ لماذا؟ لأن قانون حاصل الإذابة يكتب بدلالة التركيز وإما بدلالة درجه الإذابة.
عندما يذكر في المسألة بدلالة التركيز تستخدم العلاقة التقليدية Ksp = [Ab+]a[Ba-]b
عندما يذكر في المسألة بدلالة درجة الإذابة تستخدم العلاقة Ksp= [ax]a [bx]b
مثال: احسب حاصل الإذابة Ksp لملح فوسفات الكالسيوم Ca3(PO4)2 علماً بأن تركيز أيون الكالسيوم 2× 10-8 مولار وتركيز ايون الفوسفات
1×10-3 مولار
الحل
=3Ca2+(aq) +2PO43-(aq) (s) Ca3(PO4)2
Ksp =[Ca2+]3 [PO43-]2
= (2×10-8)3×(1×10-3)2
= 8×10-3
مثال: احسب حاصل الإذابة Ksp لملح فوسفات الكالسيوم PbBr2 علماً بأن درجة إذابته 1,04×10-2 مولار
الحل
PbBr2(s) = Pb2+(aq)+2Br-(aq)
xM 2xM
Ksp= [x] [2x]2
=(1.04×10-2)×(2×1.04×102-)2= 4.5×106-
يوجد قاعدتين وخمسة قوانين فى المنهج لازم في الإمتحان قانون ولازم قاعدة
المنهج قاعدتين فقط
1. قاعدة لوشاتليه ( كيمياء غير عضويه)
2. قاعدة ماركونيكوف (كيمياء عضويه)
يتبقى عندك خمسة قوانين لازم يأتى القانون إما مصطلح إما مفهوم علمى
1. قانون فعل الكتله
2. قانون استفالد
3. قانون فراداء الاول
4. قانون فراداء الثانى
5. القانون العام للتحليل الكهربى
تعريف التميؤ: هو ذوبان الأملاح فى الماء لتكوين الحمض والقاعدة اللذان اشتقا منهما الملح
لاحظ أن: في درس التميؤ ذكر فى كتاب المدرسه التميؤ لأربعة أملاح ولكن ينطبق معنى التميؤ على حاله واحدة فقط، فليس كل ذوبان تميؤ
شرط الذوبان أن يكون تميؤ لابد أن ينتج من ذوبان الملح (حمض ضعيف أو قلوى ضعيف أو الاثنين حمض وقلوي معاً)
علل: لا يعتبر ذوبان كلوريد الصوديوم فى الماء تميؤ
جـ: لأن ناتج التميؤ هيدروكسيد الصوديوم وحمض الهيدروكلوريك وكلاهما قلوى وحمض قويان
تحدث كتاب المدرسة عن تأثير محلول (كربونات الصوديوم، كلوريد الأمونيوم، أسيتات الأمونيوم، كلوريد الصوديوم) على ورقة عباد الشمس ولم يذكر هيدروكسيدات العناصر الانتقالية .
اعلم أن:جميع هيروكسيدات العناصر الانتقالية قلويات ضعيفة .
س: ما أثر ملح كلوريد الحديد III على ورقه عباد الشمس ؟
( نحاس – الحديد -كروم – خارصين – نيكل…) عناصر انتقاليه والعنصر الانتقالى أصله فلز يعطي أيونات موجبة ويتحد مع مجموعة الهيدروكسيد (في الماء) ويعطى (هيدروكسد العنصر الإنتقالي)
إذاً جميع هيدروكسيدات العناصر الانتقالية قلويات ضعيفة، إذاً محلول كلوريد الحديد III حمضى التأثير على ورقه عباد الشمس
الباب الرابع الكهربية
لديك خمس رسومات الأكثر تكراراً فى امتحانات الوزارة والنماذج والكتب الخارجية.
يأتى السؤال ارسم شكلا تخطيطيا مع كتابة البيانات أو يقول ارسم قطاعاً مع كتابة البيانات
1. خلية دانيال
2. قطب الهيدروجين القياسى
3. خلية الزئبق
4. خليه الوقود
5. المركم الرصاصى
تذكر في خلية دانيال: لازم تعرف تفاعل الأنود /تفاعل الكاثود /التفاعل الكلى /الرمز الاصطلاحي / القنطرة الملحية ومعرفة تركيبها وشرط محلولها/ أسباب توقف التيار
تذكر في خلية دانيال: أنود الخارصين مغمور في محلول كبريتات الخارصين، كاثود النحاس مغمور في محلول كبريتات نحاس.
علل: فى الخلايا الجلفانية ينغمس القطب فى محلول يحتوى على أيوناته؟
جـ: لرفع جهد الأكسدة لقطب الأنود ورفع جهد الاختزال لقطب الكاثود
لاحظ أن قطب الهيدروجين القياسى بدأ بسلك من البلاتين ولم ينتهى بسلك ولكن انتهى بصفيحه من البلاتين!
علل: ينتهى سلك البلاتين فى قطب الهيدروجين القياسى بصفيحه من البلاتين الاسفنجى ولم تصنع كلها من سلك بلاتين؟
جـ: لزيادة مساحة السطح المعرض للتفاعل بالتالى زيادة سرعه التفاعل
أهم الموضوعات التى أضيفت لمنهج 2016
ميكانيكية صدأ الحديد
وضح بالمعادلات أو وضح ميكانيكيه أو وضح خط سير أو وضح خطوات صدأ الحديد
نكتب الاربع معدلات ونجمعهم
تفاعلات صدأ الحديد
2Fe(s) 2Fe+2(aq) + 4e-
2H2O(ℓ) + O2(g) + 4e- 4OH –(aq)
2Fe+ + 4OH- 2Fe(OH)2(aq)
2Fe(OH)2(aq) +½ O2(g) + H2O(l) 2 Fe(OH)3(S)
بجمع المعادلات تصبح المعادلة الكلية لتفاعل خلية تآكل الحديد هي:
2Fe (s) +3H2O(l)+ 3/2 O2(g) 2 Fe(OH)3(S)
علل: تفاعل الصدأ من التفاعلات البطيئة .
جـ: لاحتواء الماء على كميات محدودة من الأيونات .
علل: يكون صدأ الحديد أسرع فى ماء البحر عن الماء العادى .
جـ: لأن ماء البحر يحتوى كميات أكبر من الأيونات بينما الماء العادى يحتوى كميات محدودة من الأيونات .
س: صدأ الحديد عباره عن:
1. أكسيد حديدII
2. أكسيد حديدIII
3. هيدروكسيد حديدII
4. هيدروكسيد حديد III
جـ:(4)
يوجد بالكيمياء الكهربية أربع مقارنات أساسية:
1. الخلايا التحليليه (الالكتروليتية أو خلايا التحليل الكهربى) وبين الخلايا الجلفانية
2. مقارنه بين الخلايا الأولية والخلايا الثانوية
3. الغطاء الأنودي والغطاء الكاثودي
4. أو اثنين من الاربع خلايا الجلفانية (اللثيوم والوقود والزئبق والسيارة) ، اللثيوم والسيارة / اللثيوم والزئبق / الوقود والزئبق / الوقود والسيارة.
يوجد ثلاثة تطبيقات هامه في الكيمياء الكهربية …وضح بالرسم مع كتابة البيانات كيف يمكن (3درجات)
1. طلاء إبريق (ملعقة) من النحاس بطبقه من الفضه حدد القطب الذي يتم توصل به (المشغولة) والقطب الذي يوصل به المادة المراد الطلاء بها
وأيونات المادة (المحلول الالكتروليتى) التي سيتم بها الطلاء فى حوض الطلاء ؟؟
2. وضح بالرسم التفاعلات الحادثه عند الأقطاب مع رسم الفرن ومعادلة الأنود والكاثود والتفاعل الكلي لاستخلاص الألومنيوم في الصناعة
3. وضح بالرسم مع كتابة البيانات كيف يمكن تنقية ساق نحاسيه من الشوائب.
مسألة الكيمياء الكهربية سيطلب حساب القوه الدافعه الكهربية يطلب فيها تحديد نوع الخليه وكيفية التعرف على نوع الخلية؟
قانون القوه الدافعه الكهربية يكتب بإحدى الطرق الآتية:
1. لو أعطى 2 جهد اختزال نأخذ جهد الاختزال الكبير (الكاثود) – جهد الاختزال الصغير (الأنود)
2. لو أعطى 2 جهد أكسده نأخذ جهد الأكسدة الكبير (الأنود) – جهد الأكسدة الصغير (الكاثود)
3. لو أعطى جهد أكسده واختزال نأخذ جهد أكسدة الأنود + جهد إختزال الكاثود
ونتعرف على نوع الخلية من إشارة القوة الدافعة الكهربية
1. (موجبة+) الخليه جلفانية ونوع التيار تلقائى والتفاعل تفاعل تفريغ
2. (سالبة-) الخليه تحليليه ( خلية تحليل كهربى) ونوع التيار غير تلقائى والتفاعل تفاعل شحن
السلسلة الكهروكميائية (سلسة الجهود أو متسلسلة الجهد الكهربية أو متسلسلة النشاط الكيميائى)
لا يوجد مصطلح يبدأ بكلمة ترتيب غير السلسلة الكهروكميائية ويأتى كما يلي:
رتب العناصر الآتية تصاعدياً كعوامل مختزلة … خلي بالك (العامل عكس العملية) يعني:
1. العنصر الذى تحدث له عمليه أكسده فهو عامل مختزل و العنصر الذى تحدث له عمليه اختزال فهو عامل مؤكسد
2. الترتيب كعوامل مختزله اذاً الترتيب فذلك حسب جهود الأكسدة
3. الترتيب كعوامل مؤكسده اذاً الترتيب حسب جهود الاختزال
الباب الخامس العضوية
عندى فى المنهج ثلاثة أجهزه فى المعمل والسؤال عليه 3( درجات)
السؤال يأتى اشرح مع رسم الجهاز المستخدم وكتابة معادلة التفاعل (لازم جهاز فى الامتحان)
1. جهاز تحضير الميثان فى المعمل
2. جهاز تحضير الإيثين (الإيثيلين) فى المعمل
3. جهاز تحضير الايثاين(الإستيلين) فى المعمل
أهم 13 نقطه هم أساس الكيمياء العضوية تأتي في صورة سؤال ما الفرق بين أو قارن بين…
1. المركبات العضوية وغير العضويه
2. الصيغه الجزئية والصيغة البنانيه
3. النفثالين و ثنائى الفينيل
4. الهيدرة الحفزيه للإيثين والإيثاين
5. التحلل الحرارى والتحلل المائى لكبريتات الإيثيل الهيدروجينية
6. المركبات الأليفاتية (الدهنية) والمركبات الأروماتية (العطرية)
7. التسميه الشائعة للكحولات والأحماض
8. تفاعل الايثانول مع حمض الكبرتيك المركز.
9. البلمره بالإضافة والبلمرة بالتكاثف مع ذكر مثال
10. التكسير الحرارى للأوكتان (بيوتان وبيوتين) ، التحلل المائى للسكر (جلوكوز وفركتوز)
11. حالات تحلل للاسترات الثلاثة (مائى حمضى- مائى قاعدي - نشادرى)
12. التصبن والتصلب
13. نيترة الطولوين ونيترة الفينول
توضيح بعض الحالات
في حالة(7) التسميه الشائعة للكحولات والأحماض لاحظ أن كتاب المدرسه لم يشرح التسمية الشائعة إلا فى موضعين (الكحولات والأحماض)
س: ما الفرق بين التسمية الشائعة للكحولات وللأحماض فى الكربوكسيلية؟
س: ما المقصود بالتسمية الشائعة للأحماض العضوية
التسميه الشائعة للكحولات بيكون حسب مجموعه الاكيل C2H5OH سمي كحول إيثيلي تبعاً لمجموعة الإيثيل (C2H5-)
الأحماض الكربوكسيلية حسب مصدرها مثلا حمض الفورميك من الكلمه اللاتينيه فورميكا معناها (النمله) وحمض الأسيتيك من كلمة (Acetum) تعنى باللاتينى الخل
في حالة (
في حالة (12) (خطيرة) قارن بين التصبن والتصلب.
التصبن: تحلل المائى قلوى (قاعدى) للإستر ينتج عنه ملح الحمض العضوي الذى يدخل فى صناعة الصابون
التصلب: هدرجه الزيوت (زيوت نباتيه سائله غير مشبعة) إلى دهون صلبه مشبعة حيث يتم ضخ تيار من غاز الهيدروجين على الزيوت غير المشبعة فتتحول من صورة سائلة غير مشبعة إلى دهون صلبة مشبعة (المسلي(سمن) الصناعي)
نقاط هامة
من طرق تحضير الكحولات طريقة هيدرة الاكين فيتحول إلى كحول(أولي/ثانوي /ثالثي)
الإيثين هو الألكين الوحيد بالهيدرة الحفزية (إماهة حفزية) = كحول أولي
جميع الكحولات فى العضويه ذات روابط أحاديه (مشبعه)
س: أكتب الصيغه الكيميائيه لكحول غير ثابت وغير مشبع
جـ: لا يوجد بالمنهج كله (غيركحول فاينيل) يتحول إلى أسيتالدهيد
في حالة(13) مقارنه بين نيترة الطولوين ونيترة الفينول
أولا: النيترة يستخدم خليط النيترة (حمض النيتريك مركز 1:1 حمض الكبرتيك مركز) على المركب المطلوب نيترته (طولوين أو فينول)
نسبة (الطولوين 3:1 خليط النيترة) = ينتج ثلاثي نيتروطولوين TNT أو حمض البكريك على الترتيب
سؤال التمييز يأتى عادة بين ألكين، ألكان أو ألكاين، ألكان يعنى بين مركب مشبع و مركب غير مشبع
الإجابة نضيف ماده ملونه (برمنجنات البوتاسيوم أو ماء البروم)حيث يزول اللون مع المركب غير المشبع (ألكين أو ألكاين)
الكحولات مواد مترددة يعنى تسلك سلوك الاحماض وسلوك القواعد تعمل معادلتين:
مرة الأولى الكحول مع فلز الصوديوم يحل الصوديوم محل الهيدروجين وهنا الكحول يسلك سلوك الاحماض
المره الثانيه تفاعل الكحول مع حمض HCl فى وجود كلوريد الخارصين ينزع مجموعة OH من الكحول وهنا الكحول يسلك سلوك القواعد.
المنهج به ستة علماء لهم أهمية في سؤال أذكر دور عالم
1. أستفالد (إيجاد علاقة بين درجة تأين المحاليل الإلكتروليتية الضعيفة α ودرجة تخفيفها)
2. كيكولي (إثبات الصيغة البنائية للبنزين)
3. جولدبرج وفاج (قانون فعل الكتلة المعبر عن العلاقة بين سرعة التفاعل الكيميائي وتركيز المواد المتفاعلة)
4. فوهلر (محطم نظرية القوى الحيوية وإثبات إمكانية تحضير مركب عضوي بالمعمل من مواد غير عضوية)
5. ماركونيكوف (إضافة متفاعل غير متماثل HXإلى ألكين غير متماثل)
6. لوتشاتيلية (نظرية العوامل المؤثرة على نظام كيميائي متزن)
+
























Miss/ Shahd Mohamed
لطلاب المرحلة الثانويه
لكتابة المعادلات صحيحة يجب :
١ ) حفظ رموز العناصر واعداد تأكسدها ( وكذلك المجموعات الكميائيه مثل الكبريتات والكربونات والهيدروكسيد ، .... الخ )
٢ ) معرفة نوع التفاعل ان كان ( تفاعل اتحاد - تفكك - استبدال احادي او ثنائي - احتراق ....الخ )
٣ ) معرفة كتابة الصيغة للمركبات .. بالاعتماد على اعداد التأكسد ..
٤ ) وزن المعادلة( مساواة اعداد الذرات في جهة النواتج مع عدد الذرات في جهة المتفاعلات ) بالضرب بعدد معين يمثل عدد
المولات .
ثانويه_عامه
الكمياء مع شهد محمد
الاستاذالجمعة 24 يونيو 2022, 9:28 am