مراجعة كيمياء تالتة ثانوى
مجموعة حمض الهيدروكلوريك المخفف
https://youtu.be/bWrjHAZytYQ
مجموعة حمض الكبريتيك المركز
https://youtu.be/pD_68k5g9C0
+
- تجميعة مراجعات نهائية كيمياء الصف الثالث الثانوي
- الخلاصه في الكيمياء الكهربية في ورقتين ثالثة ثانوي
- تلخيص الكيمياء العضوية وأهم المعادلات ثالثة ثانوي
- شرح وافى للكيمياء التحليلية ٣ثانوي عام وازهر نظام جديد أ/ سليمان الحكيم
- جميع معادلات و تحويلات الكمياء العضوية أكثر من 60 معادلة
-
شيتات مراجعة الكيمياء العضوية للصف الثالث الثانوى
الكشف عن الشق الحامضي في الأملاح البسيطة
Identification of acid radical ( anion) in sample salts
الشق Radical
عبارة عن ذرة أو
مجموعة من الذرات تسلك وكأنها ذرة واحدة وإذا كان يحمل شحنة سالبة يسمى شق حامضي
(أنيون (anion وإذا كان يحمل شحنة موجبة يسمى شق
قاعدي (كاتيون).
– شق بسيط : يتكون
من ذرة واحدة مثل : K+
, Cl– , Na+
– شق مركب: يتكون من مجموعة من
الذرات ويسمى مجموعة ذرية مثل : NH4+
, NO3– , SO42-
تحضير محلول الملح
يكشف عن الشقوق الحامضية أو القاعدية في المحلول لأنها لا تتفاعل إلا إذا كانت على هيئة أيونات ، لذلك لابد من تحويل الأملاح الصلبة إلى محاليل بإذابتها في مذيب مناسب وذلك بجزء من الملح الصلب مع حجم مناسب من المذيب، لكن السؤال الذي يطرح نفسه هو : ما كمية أو كتلة العينة التي يجب أخذها لإجراء عملية التحليل والكشف عن الأنيونات الموجودة فيها؟ وهنا يمكن القول يمنع أخذ كمية كبيرة من المادة، لأن هذا قد يؤدي إلى الحصول على معلومات مشوهة عن خصائص العينة ، إذا كانت تذوب في هذا المذيب أو ذاك. وكذلك يجب أن لا تكون الكمية المأخوذة من المادة قليلة جداً، لأنة في هذه الحالة يصبح من الصعب الكشف عن الأيونات الموجودة في العينة. لذلك يجب أن الوزن المثالي للعينة المدروسة من مرتبة 25 mg ، والذي يؤدي بعد إذابة العينة إلى زيادة حجم المحلول بمقدار 1 ml تقريباً.
وتستخدم هذه المذيبات حسب الترتيب الآتي:
1- الماء البارد
2- الماء الساخن
3- حمض الهيدروكلوريك المخفف البارد أو الساخن
4- حمض الهيدروكلوريك المركز البارد أو الساخن
5- حمض النيتريك المخفف البارد أو الساخن
6- حمض النيتريك المركز البارد أو الساخن
7-الماء الملكي ويتكون من ثلاث حجوم من حمض الهيدروكلوريك المركز + حجم واحد من حمض النيتريك المركز مع التسخين الحذر.
ملاحظة:
في حالة استخدام مذيب مركز أو ساخن يخفف المحلول الناتج ويبرد، وفي حالة الإذابة بحمض النيتريك المركز أو الماء الملكي يجب تركيز المحلول بالتبخير للتخلص من حمض النيتريك حتى قرب الجفاف ثم التبريد والتخفيف بالماء المقطر.
توزيع الأنيونات Anions distribution
صنفت الأنيونات الشائعة إلى ثلاث مجموعات وكل مجموعة تمتاز بكاشفها الخاص بها ، والذي يرسب كل الأيونات التي تحتويها، ويسمى هذا الكاشف بكاشف المجموعة Group reagent أما الكواشف التي تستعمل أثناء التجارب التأكيدية التي تجرى للتعرف عن أيونات مجموعة ما فهي تسمى بالكواشف النوعية.
1- مجموعة حمض الهيدروكلوريك المخفف Dilute Hydrochloric acid group
كاشف المجموعة هو حمض الهيدروكلوريك المخفف HCl ، وتشتمل على الشقوق التالية:
1- كربونات – (Carbonates – (CO32-
2- بيكربونات – ( Hydrogen Carbonates – Bicarbonates – (HCO3–
3- كبريتيد – (Sulphide – (S2-
4- كبريتيت – (Sulphites – (SO32-
5- ثيوكبريتات – (Thiosulphates – (S2O32-
6- نيتريت – (Nitrites – (NO2–
2- مجموعة حمض الكبريتيك المركز Concentrated sulphuric Acid Group
كاشف المجموعة هو حمض الكبريتيك المركز H2SO4 ، وتشتمل على الشقوق التالية:
1- كلوريد – Chloride – (Cl–)
2- بروميد – Bromide – (Br–)
3- أيوديد – Iodide – (I–)
4- نترات –Nitrates – (NO3–)
3- المجموعة العامة (مجموعة الترسيب) Miscellaneous Group
ليس لها كاشف معين ، وتشتمل على الشقوق التالية :
1- كبريتات Sulphates – (SO42-) –
2- فوسفات – Phosphates – (PO43-)
3- بورات – Borates – (B4O72-)
ويجب الملاحظة أن أنيونات كل مجموعة لا تتفاعل مع كواشف المجموعة السابقة ولكن يمكن أن تتفاعل مع كواشف المجموعات التالية . ويجب إتباع خطوات الكشف كما هو موضح هنا لكي تتم عملية الكشف بنجاح.
1- قبل الكشف عن أنيونات أي مجموعة لابد من تنظيف أنانيب الاختبار وهذا باستعمال فرشة تنظيف الأنابيب المستعملة في نهاية كل حصص العملي.
2- يجب الكشف عن المجموعات الثلاث حسب الترتيب كما يجب إتباع طرق العمل بدقة للحصول على نتائج صحيحة.
3- ضع في الأنبوبة (Tube) النظيفة محلول العينة وأضف محلول (solution) كاشف المجموعة وإذا لم يحدث أي شئ انتقل إلى المجموعة التالية أما إذا تكون راسب فأجري التجارب التأكيدية مستعملاً جدول الكشف المناسب.
خطوات
العمل
1) لإجراء التجربة الأساسية خذ كمية مناسبة من الملح الصلب إلى
أنبوبة اختبار ثم أضف كاشف المجموعة الأولى وهو حمض الهيدروكلوريك المخفف HCl فإذا حدث فوران أو تصاعد غاز هذا
يعني أن الأنيون ينتمي إلى المجموعة الأولي، تعرف على الأنيون من خلال إجراء
التجارب التأكيدية الموضحة في جدول تجارب الكشف عن أنيونات المجموعة الأولي.
2) أما إذا لم يحدث فوران
أو لم يتصاعد غاز أهمل المحلول وقم بتجارب المجموعة التالية وخذ كمية مناسبة من
الملح الصلب إلى أنبوبة اختبار ثم أضف كاشف المجموعة الثانية وهو حمض الكبريتيك H2SO4 المركز ، ثم سخن المحلول فإذا
كانت العينة أو الأنيون من المجموعة الثانية يتصاعد غاز.
3) إذا حدث وتصاعد الغاز
هذا يعني أن الأنيون ينتمي إلى المجموعة الثانية، تعرف على الأنيون من خلال إجراء
التجارب التأكيدية الموضحة في جدول تجارب الكشف عن أنيونات المجموعة الثانية من
الشقوق الحامضية. وإذا لم يحدث ذلك أهمل المحلول وقم بتجارب المجموعة الثالثة.
يمكنك تصنيف التجارب في جدول الكشف إلى ثلاث :-
1) تفاعلات أساسية : (تجربة أساسية)
وهي التفاعلات التي يستخدم فيها كاشف أساسي يسمي بكاشف المجموعة فهو يميز كل مجموعة من الأيونات ويختص فيها فعند استخدام هذه التفاعلات يمكن للمحلل الكيميائي من الحكم على وجود أو عدم وجود مجموعة كاملة من الأيونات.
2) تفاعلات عامة : (تجارب تأكيدية)
وهي التفاعلات التي يتفاعل فيها الكاشف مع أيونات المجموعة الواحدة أو بعض منها وقد يتفاعل مع أيونات من مجاميع أخرى، وتسمى الكواشف التي تستعمل عند إجراء هذه التجارب بالكواشف النوعية.
3) تفاعلات خاصة : (تجارب تميزية)
في هذه التفاعلات التي تكون فيها مختلف الكواشف مركبات مميزة مع أيون واحد فقط من أيونات المجموعة الواحدة، وتعطي نتيجة سلبية مع باقي أيونات المجموعة التي تنتمي إليها هذا الأيون.
وهذا هو المخطط العملي للكشف عن الشقوق الحامضية :






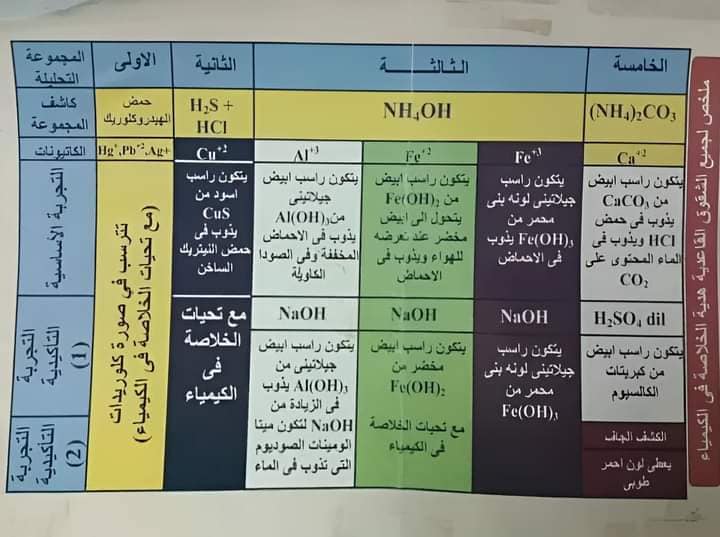
الشقوق الحامضية
Mr Gamalالسبت 18 فبراير 2023, 8:20 am